Kim loại nặng và sự tác động của nó đến cơ thể con người
Sau hơn hai mươi năm đổi mới, đất nước ta đã đạt được nhiều thành tựu đáng kể trong rất nhiều lĩnh vực: nông nghiệp, công nghiệp, giáo dục, y tế... Tuy nhiên, song song với phát triển kinh tế có rất nhiều vấn đề nảy sinh như thiên tai lũ lụt, hạn hán ...; đặc biệt là ô nhiễm môi trường sống, trong đó có ô nhiễm kim loại nặng (KLN). Trong bài này chúng tôi tóm tắt kiến thức cơ bản nhất về KLN và tác động của nó đến cơ thể con người.
* Kim loại nặng:
Theo Bjerrum (1936) KLN là các nguyên tố kim loại ở dạng nguyên tố có tỷ trọng cao hơn 7 g/cm3. Song theo thời gian định nghĩa ấy cũng có thay đổi. Từ điển KHKT do NXBKH&KT Hà Nội năm 2000 đưa ra định nghĩa kim loại nặng là kim loại có tỷ trọng d > 5 g/cm3. Gần đây IUPAC lại kiến nghị bỏ cả các khái niệm về KLN (Duffus, 2002).
Suy nghĩ của IUPAC không phải là không có cơ sở. Vấn đề phải cân nhắc không phải là kim loại nào mà vấn đề là hàm lượng cho phép là bao nhiêu. Có rất nhiều nguyên tố cần thiết cho cơ thể ở liều lượng thấp, chỉ trở nên độc khi vượt quá một ngưỡng nhất định. Có nguyên tố lại độc ở dạng này song lại trở nên có giá trị dược liệu ở dạng khác. Rất có thể ngay cả các nguyên tố ngày nay ta chưa phát hiện được chức năng sinh lý có lợi mà chỉ thấy có hại vì những tiến bộ về hoá phân tích chưa cho phép ta phát hiện ở các nồng độ thấp hơn hay các dạng hữu cơ của nguyên tố cần nghiên cứu.
Theo định nghĩa của Bjerrum thì các kim loại sau đây: Bạc (kí hiệu: Ag, có tỉ trọng d = 10,5 g/cm3), Bimut (Bi, d = 9,8 g/cm3), Cadmi (Cd, d = 8,6 g/cm3), Coban (Co, d = 8,9 g/cm3), Đồng (Cu, d = 8,96 g/cm3), Crôm (Cr, d = 7,1 g/cm3), Sắt (Fe, d = 7,87 g/cm3), Thuỷ ngân (Hg, d = 13,52 g/cm3), Mangan (Mn, d = 7,44 g/cm3), Niken (Ni, d = 8,9g/cm3), Chì (Pb, d = 11,34 g/cm3) và Kẽm (Zn, d = 7,1 g/cm3) là các KLN.
Đặc điểm chung các KLN là gây tác động đến cơ thể con người rất từ từ theo quá trình tích luỹ. Do vậy, người ta hay coi thường chúng. Khác với các hoá chất bảo vệ thực vật có tác động trực tiếp, vì thế con người thường chú ý đề phòng hơn. Tuy nhiên, đó là một quan niệm sai lầm cần thay đổi.
* Tác động của một số nguyên tố KLN đến cơ thể con người:
Kẽm (Zn)
Là nguyên tố được sử dụng rộng rãi trong công nghiệp mạ điện. Nó xâm nhập vào các hệ sinh thái nước thông qua hoạt động công nghiệp khai khoáng, thuốc diệt nấm, công nghiệp sợi tổng hợp ... Nếu nhiều kẽm, lớp nước bề mặt có bọt màu trắng (nó sẽ được hấp thụ và tích luỹ trong cơ thể cá).
Nó có mặt trong một số men đehydrogenaza, proteinaza, peptidaza … trong kích tố nội tiết của động vật như insulin, glucogen.
Đối với con người và động vật, Zn tăng cường hoạt động của các tuyến nội tiết (tuyến tuỵ, tuyến giáp, tuyến tiền liệt); Zn có tác dụng trong việc điều hoà, trao đổi chất dinh dưỡng.
Zn cần cho việc tổng hợp ARN (adnin ribonucleic). Thiếu kẽm, thành ống tiêu hoá có thể bị á sừng, niêm mạc ruột cũng biến đổi. Đã có bệnh nhân do huyết thanh thiếu Zn mà mắc bệnh đường ruột đi đến tử vong.
Thiếu Zn dẫn đến rối loạn trao đổi mỡ và đường, ức chế việc tổng hợp protit. Thiếu Zn sẽ chậm thành thục giới tính, các bộ phận sinh dục phát triển không đầy đủ. Kẽm cần cho việc tạo tinh trùng. Zn cần cho hoạt động thị giác, thiếu Zn sẽ dẫn đến mù. Trong y học đã dùng ZnSO4 làm thuốc chữa đau mắt.
Nơi phản ánh nhanh chóng và rõ ràng tình trạng thiếu Zn là huyết tương.
Trong đa số nguồn nước thiên nhiên, hàm lượng Zn rất ít chỉ nhỏ hơn 1 mg/l, nghĩa là ở giới hạn an toàn; ở nồng độ trên 5 mg/l sẽ gây cho nước mùi khó chịu. Trong nước uống Zn thường dao động từ 0.995-1 mg/l, nhưng ở nhiều nơi hàm lượng có thể vượt quá 7 mg/l. Thế nhưng, chỉ ở nồng độ cao hơn nhiều Zn mới gây độc cho cơ thể.
Hàm lượng Zn trong nước ăn uống tối đa là 3 mg/l.
Sắt (Fe)
Có mặt trong một số enzim như xitochrom, peroxydaza, catalaza, oxydaza, xantinoxydaza, xucxinatdehydrogenaza.
Đối với con người Fe có trong transferin, chất tham gia quá trình vận chuyển Fe trong huyết tương. Đại bộ phận sắt được hấp thu tập trung vào tuỷ xương, ở đây sắt đi vào hồng cầu, 60-72% Fe của cơ thể nằm trong huyết sắc tố (hemoglobin). Mỗi phân tử huyết sắc tố chứa 4 nguyên tử Fe. Trong huyết sắc tố Fe chiếm 0,34%.
Triệu chứng điển hình của việc thiếu Fe đối với con người là thiếu máu, giảm huyết sắc tố, da trở nên bệch. Triệu chứng phụ của việc thiếu Fe là tiêu chảy: càng tiêu chảy càng thiếu Fe trầm trọng.
Nguồn chính các hợp chất trong nước mặt là quá trình phong hoá hoá học đất đá kèm theo sự phân huỷ cơ học và hoà tan chúng. Các phức chất của hợp chất sắt nằm dưới dạng hoà tan, dạng keo lơ lửng được tạo thành trong quá trình tương tác các chất hữu cơ và vô cơ chứa trong nước tự nhiên. Một lượng lớn sắt tham gia vào nước mặt từ nước ngầm và nước thải của các nhà máy công nghiệp luyện kim, cơ khí dệt, sơn, nước thải công nghiệp khác. Hàm lượng của sắt lớn hơn 1–2 mg/l sẽ làm giảm giác quan của con người, ảnh hưởng đến chất lượng nước khi sử dụng.
Hàm lượng Fe trong nước ăn uống tối đa là 0,5 mg/l.
Đồng (Cu)
Đồng nằm trong các enzim xitochromoxidaza, polyphenoloxidaza (tirozinaza), laccaza.
Cu cần cho sự phát triển bình thường của xương. Thiếu đồng sẽ sinh chứng xốp xương, còi xương, tứ chi có thể biến dạng.
Thiếu Cu tính đàn hồi của thành mạch kém đi. Thiếu Cu cũng gây rối loạn hệ thần kinh trung ương có thể đi đến bại liệt.
Khi nồng độ Cu trong máu rất cao thì nguy cơ tử vong do bất cứ nguyên nhân nào sẽ tăng lên 50% và do ung thư là 40% khi so sánh với những người có nồng độ Cu trong máu ở mức bình thường.
Hàm lượng Cu trong nước ăn uống tối đa là 2 mg/l.
Mangan (Mn)
Mn hoạt hoá các men decarboxylaza, đehydrogenaza, hydrozintransferaza, các men oxydaza khác.
Đối với con người mangan cần cho quá trình kết hợp aminoxaccarit vào mucopolyxaccarit. Thiếu Mn trật tự sắp xếp tế bào xương trong vùng sinh trưởng bị rối loạn. Mn ảnh hưởng đến khả năng sinh sản, cấu tạo mô thần kinh, mô xương, việc hấp thu glucoza, trao đổi và vận chuyển mỡ trong cơ thể.
Mn không phải là tác nhân gây độc nguy hiểm vì trong nhiều nguồn nước, nồng độ của nó rất thấp, dao động từ 0.005 mg/l đến 1 mg/l. Những hoạt động khoáng, nhà máy sản xuất pin, đốt cháy nguyên liệu hoá thạch là những nguồn cung cấp Mn cho nước. Trong nước có nhiều Mn loại bỏ bằng cách thay đổi pH, độ thoáng khí và sử dụng vật liệu trao đổi ion.
Hàm lượng Mn trong nước ăn uống tối đa là 0,5 mg/l.
Coban (Co)
Thiếu Co con người kém ăn, trông mệt mỏi, thiếu máu do vậy sinh trưởng chậm, trứng khó thụ tinh nên khả năng sinh sản kém. Thiếu Co cũng gây rối loạn tiêu hoá. Thiếu Co thì cơ thể thiếu Vitamin B12.
Arsen (As)
Về mặt hoá học As là một á kim; trong danh mục các hoá chất cần được kiểm soát, As được xếp cùng hàng với kim loại nặng. As thường nằm trong thuốc trừ sâu (insecticide), thuốc trừ nấm (fungicide) và thuốc trừ cỏ (herbicude).
Trong các hợp chất có As thì hợp chất chứa As(III) là độc nhất.
As3+ tác động vào nhóm - SH của men, do vậy ức chế hoạt động của men ngăn cản việc tạo ATP (adenintriphotphat).
Vì As giống P về mặt hoá học, As can thiệp vào các quá trình hoá sinh có lân tham gia.
Trong việc tạo ATP bước tổng hợp 1,3-diphosphoglyxerat từ glyxeraldehyt-3-phosphat là rất quan trọng, song do có mặt (As03)3- nên (PO4)3- bị chiếm chỗ 1,3- diphosphoglyxerat không hình thành mà lại hình thành 1-Arseno-3-phosphoglyxerat, sau đó tự thuỷ phân không cần sự tham gia của men để tạo thành 3-phosphoglyxerat và arsenic mà không phải là ATP.
As có nguồn gốc tự nhiên và nhân tạo. Nguồn gốc tự nhiên chủ yếu của As là bụi núi lửa, xói mòn do gió, bụi lửa rừng và bụi đại dương. Nguồn gốc As nhân tạo là các quá trình nấu chảy đồng, chì, kẽm, sản xuất thép, đốt rừng và đồng cỏ, sử dụng thuốc trừ sâu diệt cỏ, đốt chất thải và từ các nhà máy sản xuất thuỷ tinh.
Hàm lượng As trong nước ăn uống tối đa là 0,01 mg/l.
Cadmi (Cd)
Cd thường đi đôi với Zn trong tự nhiên. Nó xâm nhập vào các hệ sinh thái từ nước thải công nghiệp hoá chất, mạ điện, luyện kim, chất dẻo và chất khai mỏ. Trong cơ thể người Cd gây nhiễu một số enzim nhất định, gây nên hội chứng tăng huyết áp và ung thư phổi.
Ngộ độc Cd xuất hiện ở Nhật Bản được gọi là bệnh itai itai hay “Ouch ouch”. Bệnh nhân bị ngộ độc Cd xương dòn, dễ gẫy. Ngộ độc trầm trọng thì hại thận, thiếu máu, rối loạn tuỷ xương.
Cd vào cơ thể phần lớn đi vào thận rồi được thải ra ngoài qua nước tiểu. Một phần rất nhỏ (1%) liên kết với protêin metallothionein có trong thận; phần còn lại nằm lại trong cơ thể nên hàm lượng Cd trong cơ thể tăng dần theo tuổi tác. Nếu cơ thể đồng hoá quá nhiều Cd, Cd2+ sẽ thay thế cho Zn2+ trong các men ở thận sẽ làm quá trình trao đổi chất bị rối loạn có thể gây ra các chứng bệnh thiếu máu, cao huyết áp, rối loạn tuỷ xương, ung thư.
Hàm lượng Cd trong nước ăn uống tối đa là 0,003 mg/l.
Crôm(Cr)
Dạng độc nhất là hợp chất Cr hoá trị VI, thường thấy trong nước uống, tuy nhiên dạng hoá trị III lại không độc. Có hàng loạt các muối crôm được sử dụng trong công nghiệp như công nghiệp nhuộm len, công nghệ mạ, thuộc da, xưởng sản xuất đồ gốm, sản xuất chất nổ...
Khi nhiễm Cr(VI) sẽ gây bệnh ung thư, rối loạn gen và nhiều bệnh khác.
Hàm lượng Cr trong nước ăn uống tối đa là 0,05 mg/l.
Chì (Pb)
Chì tương đối sẵn trong môi trường tự nhiên dưới dạng kim loại. Nguồn chì chủ yếu có trong khí quyển là do khí xả của động cơ đốt trong dùng xăng hay dầu có pha chì. Bụi tại thành phố, đô thị, gần đường cao tốc rất giầu chì. Hàm lượng chì trong bụi ở các phố buôn bán sầm uất có thể lên tới 1- 4 gam chì/kg bụi (0,1- 0,4%).
Mỗi ngày một người dân đô thị đưa vào cơ thể chừng 200x10-6 g đến 300x10-6 g chì, cơ thể giữ lại chừng 25x10-6 g, số còn lại theo đường bài tiết ra ngoài.
Nồng độ Pb trong không khí cho phép tối đa trung bình trong 24h là 0,005 mg/m3 (theo TCVN 5937-1995).
Hiệu ứng sinh hoá quan trọng của chì là ức chế nhiều loại men then chốt liên quan đến quá trình tổng hợp hemoglobin dẫn đến các bệnh về máu. Thí dụ như chì ức chế men amino levulinic đehydraza làm cho chất trung gian là axit delta levulinic không thể chuyển hoá thành porphobilinogen, tiền thân quan trọng của hemoglobin.
Do vậy chì ngăn cản việc chuyển vận oxy trong cơ thể và chuyển hoá gluco thành năng lượng để cung cấp cho các quá trình sống.
Khi hàm lượng chì trong máu trên 0,3 ppm sẽ xuất hiện triệu chứng thiếu máu do thiếu hemoglobin.
Khi hàm lượng chì cao hơn 0,5 - 0,8 ppm, chức năng thận bị rối loạn và cuối cùng ảnh hưởng đến hệ thần kinh.
Người nhiễm chì có thể gây tổn thương đến não.
Do Pb2+ và Ca2+ giống nhau về mặt hoá học nên Pb2+ có thể đổi chỗ cho Ca2+ nằm lại trong cơ thể, sau này Pb2+ lại có thể theo lân từ xương ra gây độc cho các mô mềm.
Người ta cũng lợi dụng đặc điểm giống nhau giữa Ca2+ và Pb2+ để chống ngộ độc chì bằng cách cho nạn nhân ngộ độc chì uống dung dịch chelat Ca2+ để kéo Pb2+ ra ngoài bằng con đường bài tiết.
Hàm lượng chì trong nước ăn uống tối đa là 0,01 mg/l.
Thuỷ ngân (Hg)
Độc tính của Hg phụ thuộc vào dạng hoá học của thuỷ ngân.
Thuỷ ngân nguyên tố hoàn toàn không độc. Nếu nuốt phải thì cơ thể lại có thể thải ra ngoài theo đường bài tiết.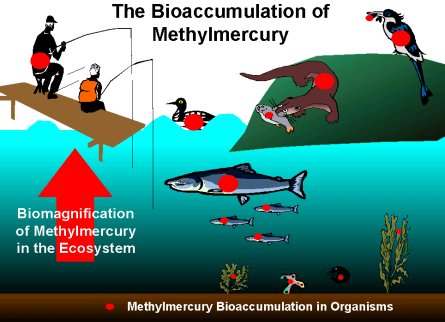
Hơi Hg độc nên phải bảo quản Hg ở chỗ thoáng mát, nếu Hg bị đổ ra ngoài thì cần nhanh chóng rắc bột lưu huỳnh (S) (S dễ dàng tác dụng với Hg ở điều kiện thường tạo thành HgS không độc). Hơi Hg hút phải sẽ qua máu lan truyền lên não khiến cho hệ thần kinh trung ương bị rối loạn.
Hg+ phản ứng với Cl- tạo thành hợp chất HgCl không tan nên dù có nuốt phải Hg+ vào dạ dày (trong dạ dày có rất nhiều HCl) cũng không bị ngộ độc.
Nhưng ion Hg2+ lại rất độc. Hg2+ có ái lực rất mạnh với S nên có thể ngưng tụ các axit amin chứa S trong protêin làm các men có bản chất prôtêin mất hoạt tính. Hg2+ liên kết với hemoglobin và albumin huyết thanh là những protêin có chứa nhóm sulphydril. Tuy nhiên, các chất này không vượt qua được màng sinh học nên không thâm nhập được vào tế bào.
Methyl thuỷ ngân (CH3Hg) là dạng độc nhất hoà tan trong nước. Vi khuẩn sống trong bùn các ao hồ tổng hợp CH4 và thải ra hợp chất trung gian methyl cobalamin, sau đó tác động với thuỷ ngân tạo thành đimethyl thuỷ ngân (CH3)2Hg trong môi trường kiềm. Chất này biến dạng xâm nhập vào nước thậm chí vào cả không khí. Trong môi trường axit, đimethyl thuỷ ngân sẽ biến đổi thành methyl thuỷ ngân (CH3Hg) hoà tan trong nước, sau đó tham gia vào cấu tạo cơ thể của cá và dần dần được tích luỹ.
Khi nhiễm Hg, nó có thể lọt qua rào chắn thai bào đi vào mô thai gây hậu hoạ cho thai nhi.
Hg nằm trong màng tế bào làm ức chế việc vận chuyển đường qua màng tế bào. Đối với tế bào não thiếu đường sẽ dẫn đến thiểu năng tế bào não và làm rối loạn xung lực thần kinh. Do vậy, con các bà mẹ bị ngộ độc methyl thuỷ ngân trong thời kỳ mang thai sẽ bị chứng liệt não, chậm phát triển trí tuệ, dễ bị co giật.
Ngộ độc methyl thuỷ ngân cũng ức chế việc phân chia tế bào.
Triệu chứng ngộ độc Hg xuất hiện khi hàm lượng methyl thuỷ ngân trong máu cơ thể đạt đến 0,5 mg/l.
Hg hiện nay được sử dụng rộng rãi trong các ngành công nghiệp: luyện kim, sản xuất pin, tế bào thuỷ ngân, đèn huỳnh quang, nhiệt kế, thuốc trừ sâu, chất diệt nấm ... Đó là nguồn quan trọng gây ô nhiễm Hg.
Hàm lượng Hg trong nước ăn uống tối đa là 0.001 mg/l.